€ 5.0890 →
|
$ 4.3140 →
|
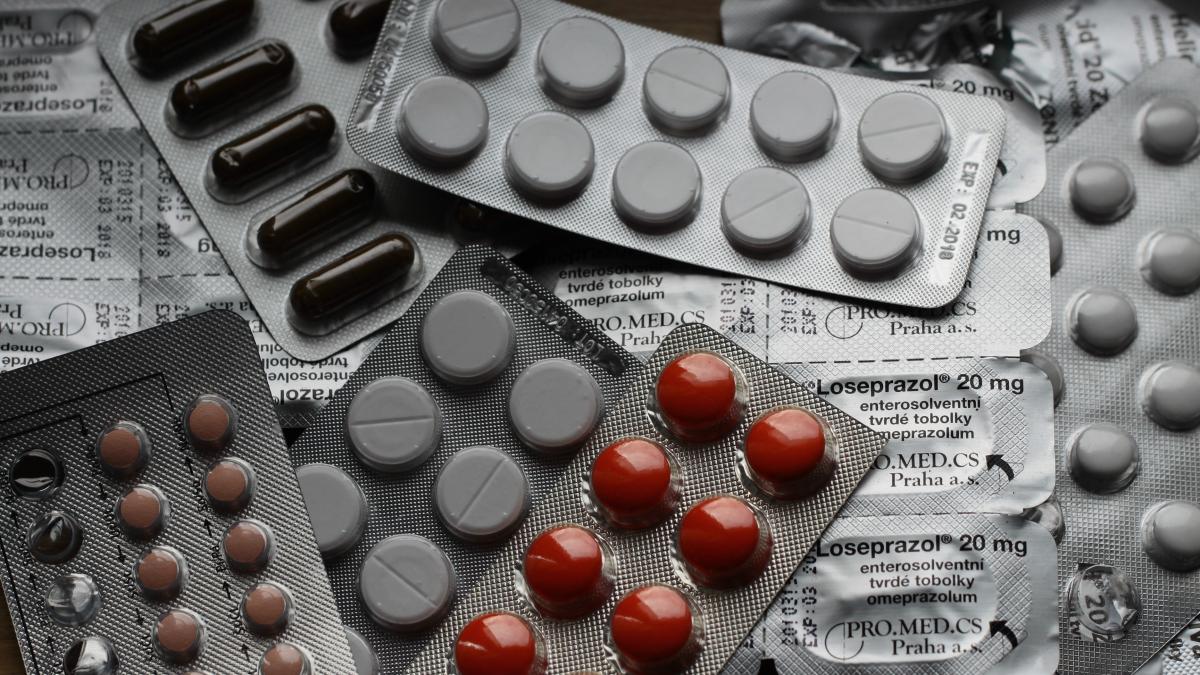 FOTO: Pexels
FOTO: Pexels
Antibiotice, paracetamol, antiepileptice, medicamente anticancerigene etc. : din ce în ce mai multe medicamente lipsesc din farmacii, în Franţa ca şi în alte părţi ale Europei, provocând îngrijorarea unor oficiali în domeniu care consideră esenţial un răspuns 'mai european' pentru rezolvarea acestei probleme, relatează AFP.
'Trebuie să avem o politică franceză de suveranitate (...), dar şi o politică europeană' pentru a răspunde penuriei de anumite medicamente, subliniază ministrul francez al Sănătăţii, François Braun.
Comisia Europeană a propus o reformă la sfârşitul lunii aprilie menită să constrângă companiile farmaceutice să se protejeze mai bine împotriva penuriilor, să le încurajeze să dezvolte noi antibiotice şi să-şi lanseze medicamentele în întreaga UE.
Dar această propunere nu va rezolva întreaga problemă, au admis deja unele voci din cadrul Comisiei, amintind că UE lucrează, de asemenea, pentru a-şi consolida suveranitatea industrială şi a-şi asigura aprovizionarea cu materii prime critice.
François Braun recomandă mai multă transparenţă din partea laboratoarelor farmaceutice cu privire la producţia lor, o mai mare solidaritate europeană atunci când o ţară are stocuri şi îi poate ajuta pe cei care nu au şi elaborarea unei liste europene a acestor medicamente esenţiale, astfel încât să se garanteze producţia lor în Franţa şi în Europa.
Leem, asociaţia care reprezintă industria farmaceutică franceză, a subliniat, la rândul său, joi dificultăţile legate de diversitatea reglementărilor în Europa şi pledează pentru o armonizare a reglementărilor naţionale pentru a facilita monitorizarea dificultăţilor de aprovizionare şi pentru a 'evita suprapunerea legislaţiilor'.
Asociaţia consideră, de asemenea, că o consolidare a mandatului Agenţiei Europene pentru Medicamente (EMA) ar putea permite 'o reacţie coordonată la nivelul UE în ceea ce priveşte riscurile sanitare şi cele de penurie'.
Potrivit Soniei de La Provrté, senatoare şi preşedintă a comisiei senatoriale de anchetă pe această temă, lipsurile s-au 'înrăutăţit în ultimii 15 ani'.
În total, în 2022 au fost înregistrate 3.500 de rapoarte de epuizări de stoc şi riscuri de epuizare a stocurilor, în creştere bruscă faţă de cele 2.160 înregistrate în 2021, potrivit unui ultimul raport transmis AFP săptămâna aceasta de către Agenţia Naţională de Securitate a Medicamentelor (ANSM).
Problema nu afectează doar Franţa: la sfârşitul lunii aprilie, pediatrii din diferite ţări europene au avertizat despre un risc pentru 'sănătatea copiilor şi a tinerilor noştri' din cauza lipsei de medicamente în toată Europa.
Statele Unite sau Canada sunt, de asemenea, afectate. Exista multe cauze ale penuriei, adesea cu o legătură cu contextul internaţional: capacitate de producţie insuficientă, complexitatea lanţurilor de producţie, nevoia crescută de medicamente pe fondul îmbătrânirii populaţiei, concentrarea producătorilor, dificultăţi în aprovizionarea cu materii prime, defecte de calitate asupra medicamentelor, efecte ale crizelor internaţionale, inflaţie etc.
Relocare în Europa La nivel naţional, este nevoie de 'mai multă vigilenţă la feedback-ul semnalelor, mai multă anticipare cu producătorii şi să se recurgă la molecule de substituţie atunci când este posibil', a afirmat pentru AFP Philippe Coatanea, vicepreşedinte al Consiliului naţional al ordinului farmaciştilor.
Însă, potrivit lui, 'soluţia poate fi doar o parte a unei strategii internaţionale, şi cel puţin europeană, de anticipare, mai degrabă decât a acumula sisteme franco-franceze din ce în ce mai coercitive şi mai rigide', afirmă el.
'Adevăratul răspuns european este de a reloca producţia de molecule esenţiale în Europa, la un preţ rezonabil. Competenţele exista în Europa, dar este un teren pe care Comisia nu merge în prezent', deplânge economistul Nathalie Coutinet, de la Universitatea Sorbona Paris Nord.
În plus, UE nu are în prezent competenţa de a stabili preţurile medicamentelor, care sunt responsabilitatea autorităţilor naţionale în contextul negocierilor cu producătorul, precum şi ratele de rambursare.
'Piaţa europeană este o piaţă mare, matură. Dacă este organizată şi vorbeşte cu o singură voce, în negocieri, aceasta cântăreşte chiar mult pe planul de afaceri al laboratoarelor', subliniază Sonia de La Provrté.
Unele dintre aceste propuneri sunt incluse în pachetul prezentat de Comisia Europeană. Rămâne de văzut dacă această reformă va putea fi adoptată înainte de alegerile europene din iunie 2024. În caz contrar, soarta ei ar fi destul de incertă, scrie Agerpres.
„Există la nivel european o asociație a producătorilor de medicamente, inovativă, ea se cheamă Federația Europeană a Asociațiilor şi Industriei Farmaceutice (EFPIA) care face un studiu foarte interesant în fiecare an. Ia un eșantion de medicamente nou autorizate într-o perioadă de timp, ultima este 2018-2021, pentru a fi comercializate în UE și se uită în cât timp au devenit ele disponibile pacienților în fiecare țară a uniunii, un studiu comparativ. După aceea prezintă datele și arată care țări au acces rapid, care au acces întârziat, astfel încât autoritățile respective să poată lua măsuri.”, a spus economistul sanitar Radu Comșa.
„Ediția de anul acesta a cuprins 37 de țări europene, dintre care ele 27 state membre ale uniunii, 168 de medicamente inovatoare aprobate la nivel centralizat de Agenția Europeană a Medicamentului, în perioada 2018-2021, și informațiile sunt structurate pe disponibilitate. Câte la sută dintre medicamentele aprobate la nivel european sunt disponibile în țările din studiu și pe timpul de la autorizarea europeană până la disponibilitatea națională.
Din cele 168 de medicamente aprobate la nivel european în perioada 2018-2021, în România sunt rambursate, la data de 5 ianuarie 2023, 58 de medicamente. Practic 1 din 3 medicamente autorizate la nivel european sunt disponibile pacienților din România. Media europeană este de 45%, în scădere cu 2 puncte procentuale fără de studiul de anul trecut.
În cât timp sunt disponibile aceste medicamente? Pentru România în 918 zile, în creștere față de studiul de anul trecut în care erau disponibile în ziua 899. Media europeană este de 517 zile de la momentul autorizării europene. Timpul a crescut, dar trebuie subliniat și un alt lucru. Am zis că 1 din 3 sunt disponibile. În ediția de anul trecut a acestui studiu, vorbeam de 1 din 4 medicamente. Avem pe de o parte o veste bună, pe de altă parte, un aspect la care ar trebui să lucrăm împreună, autorități, industrie, asociații de pacienți, ca să îmbunătățim acest lucru”, a spus Dr. Ioana Bianchi.
Fiți la curent cu ultimele noutăți. Urmăriți DCNews și pe Google News

 Fiat Justitia, pereat mundus-adevăratul înțeles al expresiei care justifică protestele din Piața Victoriei
Fiat Justitia, pereat mundus-adevăratul înțeles al expresiei care justifică protestele din Piața Victoriei
de Val Vâlcu